10 ans de l'Institut de la Vision, la recherche à grands pas

Si le temps de la recherche paraît souvent très long, et tout particulièrement pour les patients atteints de pathologies ne disposant d'aucun traitement, la recherche sur les maladies de la vision avance pourtant à vive allure. Célébrés fin 2019, les 10 ans de l'Institut de la Vision, qualifié d'un des centres de recherche sur la vision les plus importants au monde” par le haut comité d'évaluation de la recherche et de l'enseignement scientifique, l'ont attesté. Ces dix dernières années ont en effet été ponctuées de progrès majeurs en matière de lutte contre la cécité et les maladies de la vision. Dix années racontées au travers de dix avancées, histoire d'en prendre toute la mesure...
Le Pr José-Alain Sahel
Si la recherche se mesure généralement en nouvelles connaissances et nouveaux traitements, elle ne doit pas faire oublier l'histoire des hommes et des femmes qui s'y consacrent pleinement. Le Pr José-Alain Sahel est de ceux-là. Professeur à la Faculté de médecine de Sorbonne Université, clinicien-chercheur dans le domaine de la vision, il s'est spécialisé sur les maladies incurables de la rétine et s'est imposé comme l'un des pionniers en matière de rétine artificielle. Fort de découvertes fondamentales majeures, il compte parmi les scientifiques les plus reconnus et respectés dans le monde entier. Il est le fondateur et l'actuel dirigeant de l'Institut de la Vision, devenu en l'espace de dix ans un centre de référence international contre les maladies de la rétine et plus généralement les maladies de la vision.

Pr José-Alain Sahel © Inserm / Delapierre, Patrick
Les circuits de la vision mis en lumière
La vision est un système particulièrement complexe qui est encore loin d'avoir délivré l'intégralité de son mode d'emploi. Si l'on connaît aujourd'hui l'implication des circuits neuronaux de la rétine et du cerveau dans le processus de vision, il était essentiel d'en comprendre l'organisation et le développement afin de mieux appréhender et, surtout, mieux traiter les pathologies visuelles associées. C'est ainsi qu'ont été mises en place à l'Institut de la Vision, avec Jean Livet (Directeur de Recherche Inserm), de nouvelles méthodologies d'ingénierie génétique et d'imagerie. En 2014, un système de marquage multicolore inédit a permis d'identifier et caractériser efficacement les neurones générés par les cellules souches neurales. Les équipes ont ensuite réussi à mettre au point une approche de microscopie permettant de visualiser ces marqueurs dans le tissu nerveux, jusqu'alors inaccessible, et ce avec une précision sans précédent. Ces avancées ont ouvert la voie à de nouvelles études sur le développement cérébral et rétinien ainsi que les circuits de la vision.
Les réseaux neuronaux en 3D
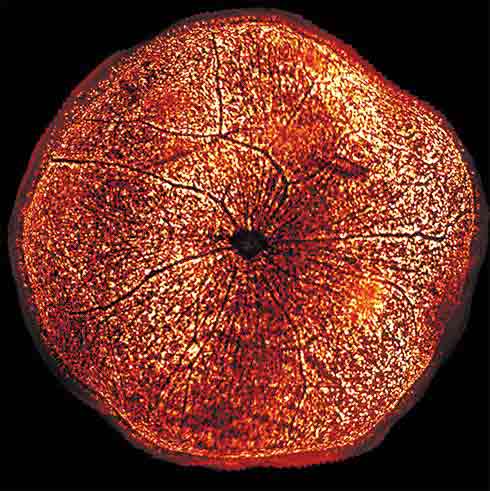
Les connexions entre l'œil et le cerveau sont au cœur du système visuel. On sait que les cônes et bâtonnets transforment la lumière en signal électrique, qui lui-même se propage aux cellules ganglionnaires, dont les longs prolongements (axones) assurent, via le nerf optique, la connexion entre la rétine et le cerveau. Certaines pathologies comme le glaucome, qui consiste en une altération du nerf optique, rompent ces connexions. Jusqu'alors, l'observation au microscope de ces neurones rétiniens était complexe et laborieuse. Or de nouvelles méthodes d'imagerie ont vu le jour : l'Institut de la Vision a par exemple été le premier centre au monde à utiliser un microscope à feuillet de lumière. Cela a permis aux équipes autour de Alain Chedotal (Directeur de Recherche Inserm) d'exploiter cette approche de transparisation, suivie d’imagerie par microscopie à feuillet de lumière. Concrètement, cela permet de visualiser en 3D les neurones préalablement marqués dans un contexte de tissus rendus transparents à la lumière. Ces avancées ont d'ores et déjà permis de faciliter l'analyse des neurones rétiniens chez des rongeurs et d'accélérer la recherche de nouveaux traitements.
© Institut de la Vision : Image 3D d'un œil de souris transpiré. Les cellules ganglionnaires sont les petits points orange tapissant la surface de la rétine. Le disque noir au milieu est l'entrée du nerf optique.
Vers une meilleure compréhension de la DMLA
Véritable enjeu de santé publique, la dégénérescence maculaire liée à l'âge (DMLA) est aujourd'hui la première cause de malvoyance après 50 ans dans les pays développés : elle affecte environ 8 % de la population, dont 25 à 30 % des personnes âgées de plus de 75 ans, et consiste en une perte progressive de la vision centrale. Dès 2007, il a été constaté que la DMLA, que ce soit dans sa forme sèche comme sa forme humide, était caractérisée par une accumulation anormale sous la rétine de macrophages, ces cellules de défense dont le rôle est normalement d'éliminer les bactéries. Depuis 2012, à l'Institut de la Vision, une équipe de chercheurs menée par Florian Sennlaub (Directeur de Recherche Inserm) a permis d'expliciter la forte composante génétique de cette maladie dégénérative, en déterminant les principaux gènes impliqués (variant du CFH et l'isoforme APOE2) et, surtout, leur rôle : ce sont notamment les responsables du maintien et donc de l'accumulation des macrophages sous la rétine, donnant lieu à la destruction progressive des photorécepteurs. Ces découvertes constituent une avancée de taille dans le développement de nouvelles stratégies thérapeutiques pour la DMLA et mais aussi des inflammations chroniques.
Une thérapie contre la rétinopathie pigmentaire
On estime aujourd'hui à 30 000 le nombre de personnes touchées en France par la rétinopathie pigmentaire, avec une prévalence d'environ 1/4000 naissances. Elle est l'une des formes les plus courantes de maladies génétiques dégénératives de la rétine. Elle se caractérise notamment par la perte progressive des photorécepteurs (cônes et bâtonnets) et un dysfonctionnement de l'épithélium pigmentaire. Pour rappel, les cônes sont en charge de la vision des couleurs, tandis que les bâtonnets sont responsables de la vision nocturne. Si elle s'attaque dans un premier temps aux bâtonnets, elle dégrade ensuite les cônes, alors qu'ils ne sont pas initialement touchés par l'anomalie génétique, avec pour conséquence une dégradation de la vision jusqu'à la cécité totale. La molécule RdCVF (pour Rod-derived Cone Viability Factor), fabriquée par les bâtonnets, étant en fait indispensable aux cônes, sa disparition explique la destruction en chaîne des photorécepteurs. Pour empêcher la perte secondaire des cônes, des équipes de l'Institut de la Vision, guidées par Thierry Leveillard (Directeur de Recherche Inserm), ont alors démontré qu'un traitement par RdCVF permettait, chez l'animal, de stopper l'évolution de la maladie. C'est ainsi qu'a été créée la société SparingVision qui produit la molécule RdCVF, afin d'être administrée aux patients atteints de rétinopathie à un stade précoce prochainement sélectionnés à l’hôpital des Quinze-Vingts pour un essai clinique.
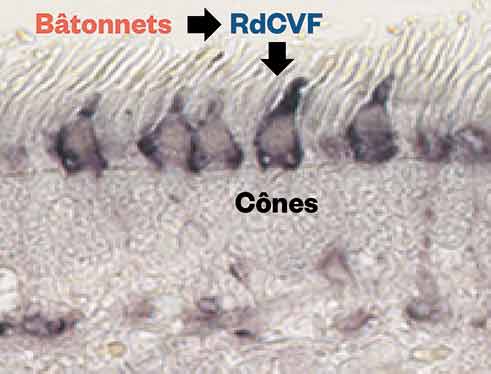
© Institut de la Vision : RdCVF : Rod-derived cone viabilty factor
Le point sur la neuropathie optique héréditaire de Leber (NOHL)
Il s'agit d'une maladie génétique mitochondriale rare, qui entraîne une baisse brutale jusqu'à la perte de la vision, sur les deux yeux. Elle concerne les hommes dans 80% des cas et se manifeste surtout entre 15 et 30 ans. S'il n'existe pour le moment aucun traitement permettant de prévenir ou stopper la baisse d'acuité, de nombreux espoirs sont portés par la thérapie génique afin de corriger par injection intravitréenne l'anomalie au sein des mitochondries. Le vecteur de thérapie génique GS010, développé par la Biotech Gensight Biologics, a donné lieu à plusieurs essais et études à l'Institut de la Vision, afin d'en déterminer la sécurité, la tolérabilité mais aussi l'efficacité pour l'homme. Deux études ont démarré fin 2015, qui ont tous deux attesté d'une amélioration moyenne d'acuité ainsi que d'une amélioration de la qualité de vie des patients, et une autre, toujours en cours, délivrera ses résultats fin 2020.
A lire aussi : Thérapie génique et maladies des yeux
Mieux soigner la douleur oculaire
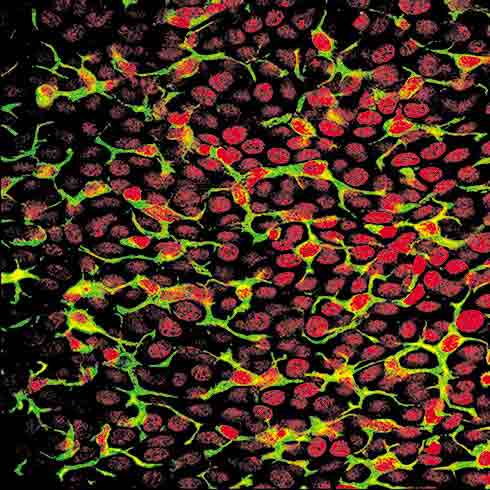
La sécheresse oculaire est l'un des premiers motifs de consultation chez l’ophtalmologiste : caractérisée par une douleur à intensité variable, cette pathologie concerne entre 5 et 35 % des personnes de 50 ans et plus. Elle compte parmi les douleurs oculaires fréquentes, dont les causes sont multifactorielles (climatisation, pollution, allergies, travail sur écran, etc.) et les traitements, peu nombreux, à l'efficacité limitée. C'est pourquoi les équipes de l'Institut de la Vision, menées par le Professeur Christophe Baudouin, se sont attelées à mieux en comprendre les mécanismes et ont découvert le rôle de l'inflammation chronique dans le dessèchement oculaire. Aussi, a été mis à jour le rôle néfaste des conservateurs des collyres, responsables de réactions inflammatoires pour plus de la moitié des patients traités sur le long terme. Ces connaissances ont permis, en collaboration avec l'industrie pharmaceutique, de développer de nouveaux collyres, sans conservateur, pour mieux traiter les douleurs oculaires. La création d'un centre de prise en charge de la douleur oculaire créé au sein de l'hôpital des Quinze-Vingts et l'étude de nouveaux biomarqueurs sont autant d'espoirs d’améliorer la douleur des patients atteints de ces maladies oculaires chroniques.
© Institut de la Vision : réseau de cellules inflammatoires à la surface conjonctive
A lire aussi : Mieux connaître les douleurs oculaires chroniques pour mieux les soulager
Rendre la vue avec la rétine artificielle
Les résultats des premiers essais cliniques ont été publiés fin 2019, laissant place à de nombreux espoirs pour tous les patients concernés par des maladies dégénératives de la rétine. En effet, ces essais viennent consacrer dix années de recherche et d'avancées, portées par l'ambition de l'Institut de la Vision de rendre la vue aux personnes aveugles. La rétine artificielle, ou prothèse rétinienne, consiste à pallier l'envoi des signaux électriques après la destruction des cellules photoréceptrices en réactivant électriquement les neurones qui envoient l'information au cerveau. Créée en 2011 pour produire des prothèses sous-rétiniennes, l'entreprise Pixium Vision a ainsi développé Prima. Après des essais réussis sur des primates non-humains, les premiers essais réalisés sur des personnes atteintes de DMLA ont été couronnés avec des succès qui ont dépassé les attentes puisque les patients ont retrouvé une capacité à relire des mots : une première en la matière ! En dix ans, Serge Picaud (Directeur de Recherche Inserm et Directeur adjoint de l’Institut de la Vision) avec ses équipes de l’Institut de la Vision ont ainsi joué un rôle fondamental dans le développement de la rétine artificielle. Et le rêve des chercheurs de rendre la vue n'a jamais été aussi accessible...
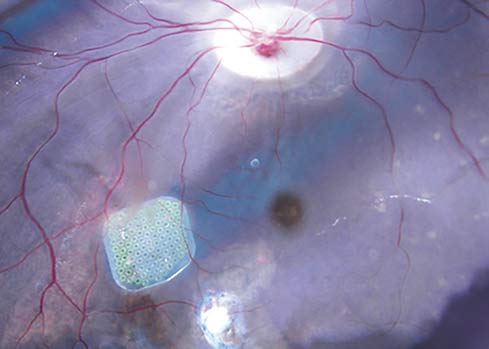
© Institut de la Vision : prothèse sous-rétinienne Prima au fond d'œil
A lire aussi : Rétine artificielle, premiers espoirs confirmés !
Les espoirs de la thérapie optogénétique

Aux côtés des prothèses rétiniennes, la thérapie optogénétique, développée à l’Institut de la Vision par les chercheurs Jens Dübel et Deniz Dalkara (Directeur de Recherche Inserm), compte parmi les pistes très prometteuses pour rendre la vision aux personnes aveugles. Cette thérapie est issue d'une protéine d'algue unicellulaire, la channelrhodopsine, qui en présence de lumière produit un courant électrique. Le principe de l'optogénétique : modifier génétiquement à l'aide de vecteurs viraux les cellules défectueuses de la rétine afin de les rendre à nouveau sensibles à la lumière. Après des essais concluants sur des tissus humains, des rongeurs et des primates non humains, les premiers essais cliniques ont commencé, avec des patients atteints de rétinopathie pigmentaire. Les chercheurs ont alors dû développer un dispositif intelligent de capture d’image combiné à la stimulation optogénétique : les patients doivent ainsi porter des lunettes dotées de caméra pour augmenter l'intensité lumineuse des images. L'évaluation fonctionnelle des patients permettra alors de définir l'acuité visuelle procurée par cette nouvelle forme de thérapie.
© Institut de la Vision : visualisation au microscope d'une fovéa, la partie centrale de la rétine. La fovéa est la région de l'œil responsable de l'acuité visuelle, nous permettant de lire, conduire ou encore reconnaître des visages.
A lire aussi : Optogénétique, la thérapie par la lumière
Du côté de la thérapie cellulaire
Produire des cellules rétiniennes à partir de cellules souches pluripotentes humaines et les greffer dans l’œil pour remplacer les cellules défectueuses : tel est l'objectif de l’équipe de Olivier Goureau (Directeur de Recherche Inserm) à travers la thérapie cellulaire pour réparer les tissus endommagés de la rétine. Fortes de leurs connaissances sur le fonctionnement de la rétine, cette équipe de chercheurs ont alors réussi à créer puis à transplanter, sous la rétine de rats atteints de rétinite pigmentaire d’origine génétique, un “patch” de cellules déjà fonctionnel, constitué de cellules de l'épithélium rétinien dérivées de cellules pluripotentes humaines. Cela a fonctionné, améliorant les performances visuelles des rats. Ces résultats ont récemment été validés chez le singe, dont la rétine est très proche de celle de l'homme, et ont permis la mise en place d'un essai clinique de thérapie cellulaire sur la rétine : une première en France. D'autant que les espoirs sont grands car cette forme de thérapie pourrait un jour concerner les patients qui présentent des pathologies dégénératives de la rétine.
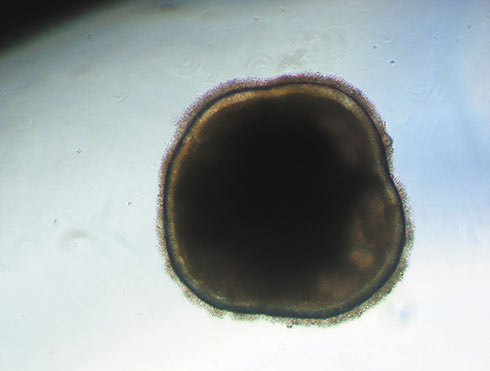
© Institut de la Vision : organoïde de rétine obtenu à partir de cellules souches humaines
A lire aussi : Greffe cellulaire et rétine, une 1ère en France
Observer la rétine au plus près
Saviez-vous qu'une infime partie (quelques photons) de la lumière que nous recevons se réfléchit et ressort de l’œil ? Aujourd’hui, l’enjeu consiste à extraire les informations de cette lumière grâce à un ensemble de technologies. Aux côtés de l’optique adaptative ont été développées des techniques originales comme la tomographie de cohérence optique plein champ, l’illumination structurée et l’holographie Doppler, offrant de nouvelles vues sur la rétine. Résultat : grâce au travail du Pr Pâques et de son équipe, il est désormais possible d'observer les interactions entre les cellules en cause dans les maladies de la rétine, avec l'espoir d'élucider de nouveaux mécanismes, pour la DMLA mais aussi des maladies plus rares. Les informations récupérées pourraient aussi permettre de mieux comprendre des maladies générales comme l’hypertension artérielle.
Pour continuer à faire avancer la recherche, faites un don
Que vous soyez un particulier, une entreprise ou une association, le soutien de chaque donateur représente une opportunité exceptionnelle pour encourager et faire avancer la recherche et l’innovation à l’Institut de la Vision. Dès maintenant, n’hésitez pas à faire un don : rendez-vous sur www.institut-vision.org ou par téléphone au 01 53 46 26 48. Par courrier, adressez votre chèque de don à l’ordre de la Fondation Voir & Entendre au 17, rue Moreau, 75012 Paris.
À lire aussi

Prévention & vision : qui consulter ? A quel âge ?
L’œil est un organe précieux et fragile. Ne dit-on pas de quelque chose à laquelle on est très attaché « j’y tiens comme à la prunelle de mes yeux » ? Il est important de faire contrôler et de préserver ses yeux afin d’acquérir dès le plus jeune âge une bonne vue, et de la conserver toute la vie. L’œil, cette bille de 2,5 cm de diamètre et pesant seulement 7 grammes, abrite pourtant un système très complexe. Directement relié au cerveau, l’œil nous permet de voir et d’interagir avec le monde extérieur.

Visite guidée à l'Institut de la Vision
Construit au cœur du Centre Hospitalier National d’Ophtalmologie (CHNO) des Quinze-Vingts à Paris, l’Institut de la Vision est l’un des plus importants centres de recherche scientifique et médicale en Europe entièrement dédié aux maladies de la vision.









