L’optogénétique, de l’algue à la rétine

Qualifiée “d’avancée de la décennie” par le magazine Science en 2010, l’optogénétique a depuis plus d’une dizaine d’années ouvert un nouveau champ de recherche en matière de neurosciences. Véritable combinaison de l’optique et du génie génétique, elle a permis une plus grande connaissance du cerveau mais aussi ouvert de larges perspectives dans de nombreux domaines, notamment celui de la vision. Suite aux résultats précliniques très encourageants obtenus par les équipes de l’Institut de la Vision, cette méthode pourrait-elle un jour permettre de donner ou restaurer la vision à des non-voyants ? Pour mieux comprendre cette technique révolutionnaire, le point avec Deniz Dalkara, biologiste moléculaire, chercheuse à l’Inserm et chef d’équipe à l’Institut de la Vision à Paris.
Comment est née l’optogénétique et en quoi consiste-t-elle exactement ?
L’histoire de l’optogénétique a réellement commencé au début des années 2000 avec la découverte de la channelrhodopsine, une protéine issue d’une algue unicellulaire. Si nous avons mis un peu de temps à comprendre comment elle fonctionnait, nous savons aujourd’hui que cette protéine transmembranaire consiste en un canal ionique activé par la lumière. Véritable avancée en matière de neurosciences, l’optogénétique est donc une méthode fondée sur cette protéine qui consiste à introduire dans les neurones une protéine sensible à la lumière et capable de créer un courant électrique au travers de la membrane cellulaire. Grâce à cette photosensibilité des cellules, nous pouvons contrôler leur activité en les excitant ou, au contraire, en les inhibant via un faisceau lumineux.
Quelles sont les applications de l’optogénétique ?
Les applications de l’optogénétique sont nombreuses et ont permis une plus grande connaissance du fonctionnement du cerveau. A l’Institut de la Vision, nous travaillons entre autres sur les maladies neurodégénératives - comme la DMLA ou la rétinite pigmentaire -, responsables de la destruction progressive des cellules de la rétine sensibles à la lumière, avec pour conséquence une perte de fonctionnement des photorécepteurs menant à la cécité. L’axe de recherche majeur de l’optogénétique en matière de vision est donc d’utiliser les protéines sensibles à la lumière, notamment la channelrhodopsine qui est une protéine de la même famille que celles naturellement présentes dans les cônes et bâtonnets de la rétine, et de les implanter dans les cellules défectueuses à l’aide de vecteurs viraux pour ensuite les stimuler par la lumière.
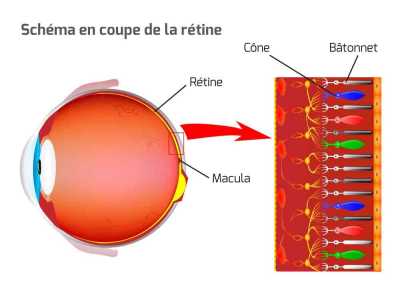
Comment passe-t-on d’une protéine d’une algue à la rétine ?
Pour exprimer une protéine qui vient d’une algue dans une cellule mammifère, il faut de très nombreuses manipulations au niveau de l’ADN et des cellules à cibler. Les scientifiques ont donc cloné la séquence ADN de la channelrhodopsine et l’ont introduite dans un virus adéno-associé : il s’agit d’un virus à ADN, qui peut infecter l’être humain mais sans provoquer de maladie ni entraîner de réponse immunitaire. Ensuite, ce virus va transporter l’ADN codant la channelrhodopsine vers le noyau des cellules cibles. Ces manipulations sont particulièrement techniques et complexes mais, une fois à l’intérieur du noyau, ces gènes optogénétiques vont exprimer la channelrhodopsine et les cellules vont ainsi devenir sensibles à la lumière.
Où en êtes-vous en matière de développement ?
Nous sommes au stade de développement préclinique et nous avons déjà obtenu des résultats très encourageants : les expériences menées sur les souris montrent que les cellules répondent de façon positive à la lumière. Sous l’initiative du Pr Sahel, une certaine partie de nos travaux tendent à aller vers un développement clinique : l’idée est de valider la faisabilité de ce projet complexe qui va de l’algue à la restauration de la vision chez le patient en passant par la souris et le primate. Nous avons réalisé les premiers essais sur des rétines post-mortem de macaques et d’humains. L’expérience s’est montrée concluante, même si ces résultats doivent être complétés par des études chez l’homme, afin de déterminer les paramètres pharmacologiques nécessaires pour obtenir la même efficacité.

Deniz Dalkara, Chef d’Equipe, CR1 Inserm à l’Institut de la Vision* - Thérapies géniques et modèles animaux des maladies neurodégénératives.
*Institut de la Vision : centre de recherche intégrée sur les maladies de la vision basé à Paris, labellisé « Laboratoire d’excellence » par le ministère de la recherche. Avec tous nos remerciements.
Pour faire un don, rendez-vous sur le site de l'Institut de la Vision >>
Crédit photo © Laurent Ardhuin pour l’UPMC
À lire aussi

Recherche et rétinopathie diabétique
La rétinopathie diabétique est une pathologie qui atteint la rétine de l’œil. Elle est due à une grave complication d'une maladie générale : le diabète.

Campagne de prévention contre le rétinoblastome
Nouvelle campagne de prévention santé : l’Institut Curie et l’association Rétinostop sensibilisent parents et professionnels de santé au risque de rétinoblastome chez l’enfant.









