L'édition de gènes, une nouvelle ère pour la thérapie génique en ophtalmologie

Face aux maladies rétiniennes héréditaires responsables de handicaps visuels souvent lourds, les meilleurs espoirs pour les patients se fondent depuis plusieurs décennies sur la thérapie génique. Et si depuis 15 ans l’explosion des virus adéno-associés (Adeno Associated Virus, AAV) apporte une avancée majeure, grâce à la possibilité d’injecter directement dans l’œil une copie saine du gène défectueux, les nouveaux outils d’édition du génome déclinés pour les cellules humaines depuis moins de 10 ans pourraient bien être le futur de la thérapie génique pour les 10 prochaines années.
Décryptage avec la Dr Juliette Pulman, chercheuse à l’Institut de la Vision.

Dr Juliette Pulman
PhD, PharmD, PostDoc INSERM UMRS968, Institut de la Vision, Paris
© Institut de la Vision – SU_LArdhuin
« Il s’agit d’une nouvelle corde à notre arc, permettant d’ouvrir de nouvelles options thérapeutiques lorsque les autres approches atteignent leurs limites » déclare la Dr Juliette Pulman, expliquant que l’objectif est bien de compléter l’arsenal mais non de remplacer les outils efficaces existant. Pharmacienne de formation et dotée d’un doctorat en génétique, elle mène au sein de l’équipe « Thérapie génique et modèles animaux pour la dégénérescence » dirigée par la Dr Deniz Dalkara (environ 15 personnes) une petite équipe focalisée sur les nouveaux outils révolutionnaires d’édition du génome.
« Ces outils très efficaces et encore mal connus qui nous viennent des bactéries ouvrent un potentiel énorme tant en termes de recherche que de nouvelles thérapies » affirme-t-elle.
[Voir encadré ci-dessous : "La création de modèles grâce à l’édition de génome"]
" Il s'agit d'une nouvelle corde à notre arc, permettant d'ouvrir
de nouvelles options thérapeutiques lorsque les autres approches atteignent leurs limites"
La création de modèles grâce à l'édition de génome
L’avancée scientifique majeure apportée par la technologie révolutionnaire CRISPR-Cas9 permet tant d’éliminer que d’ajouter des fractions de matériel génétique avec une extrême précision. Elle peut ainsi être utilisée à la fois pour neutraliser des gènes, corriger des maladies génétiques mais… aussi pour créer des modèles animaux mimant des pathologies humaines.
Ces modèles animaux vont du simple nématode (petit vers rond) à des modèles souris, ou même primates lorsque les études arrivent à un stade avancé proche de l’utilisation chez l’humain. « La technique CRISPR-Cas9 a énormément simplifié la création des modèles animaux, qui nécessitait auparavant plusieurs années mais qui dorénavant est beaucoup plus rapide, de l’ordre de quelques mois selon la complexité » indique la Dr Juliette Pulman. Rappelons que ces modèles animaux sont utilisés dans un cadre éthique réglementaire très encadré en France, afin d’étudier des maladies et ainsi mieux en comprendre le fonctionnement. « Ils peuvent aussi ensuite également être utilisés pour effectuer des essais pré-cliniques de nouvelles thérapies innovantes » précise la chercheuse.
Retour sur la puissance des AAV, Adeno Associated Virus
« Comprendre d’où l’on vient pour savoir où l’on va » disait le célèbre paléontologue, Yves Coppens, qui nous a quittés tout récemment. Depuis une quinzaine d’années, ce sont les Adéno Associated Virus (AAV) dérivés des adénovirus qui marchent le mieux dans quasi tous les domaines. « C’est en ophtalmologie que l’on a été pionnier avec ces vecteurs, notamment à l’Institut de la Vision, car l’œil présente l’avantage d’être un compartiment petit et isolé, de fait privilégié sur le plan immunologique » rappelle la chercheuse, expliquant que ses caractéristiques en font un « modèle idéal » pour expérimenter de nouvelles formes de thérapies. Le développement du Luxturna en est le cas d’école parfait, mais à ce jour le seul.
[Voir encadré ci-dessous : "Un exemple de thérapie génique réussi en ophtalmologie… mais un seul !"]
Thérapie innovante qui a le potentiel de fournir un bénéfice à long terme pour les patients atteints de maladies rétiniennes héréditaires, la thérapie génique utilise ainsi jusqu’à présent essentiellement la technique d’ajout de gènes. Or il existe certaines situations complexes dans lesquelles cette technique ne peut être utilisée, comme par exemple pour les maladies autosomiques dominantes. Dans le cas de ces dernières, des mutations spécifiques génèrent en effet une protéine toxique qui doit être réduite au silence, et l’ajout de gène resterait impuissant pour corriger le problème. Autre contexte dans lequel l’empêchement sera d’ordre « mécanique », lié à la taille du gène incriminé : lorsque celui-ci, et donc sa copie saine, dépasse la capacité limite pour son insertion dans le vecteur AAV. C’est le cas par exemple du gène ABCA4, impliqué dans les dystrophies rétiniennes et la rétinopathie pigmentaire, ou encore le gène USH2A en cause dans le syndrome de Usher.
Un exemple de thérapie génique réussi en ophtalmologie… mais un seul !
Toujours cité car seul disponible en ophtalmologie parmi la dizaine de médicaments innovants de thérapie génique approuvés sur le marché, le Luxturna est une thérapie par addition de gène via un vecteur adéno-associé (AAV), qui est indiqué dans la dystrophie rétinienne liée à la mutation du gène RPE65. Il est un très bel exemple de réussite car il représente le premier traitement proposé dans cette maladie, qui plus est assez “simplement” puisqu’une seule injection sous-rétinienne est nécessaire.
Cette injection directement dans l’œil, au plus proche de la rétine, demande tout de même quelques précautions et est réalisée uniquement à l'hôpital par des chirurgiens spécialisés. Le mécanisme d’action est assez séduisant puisque cette approche thérapeutique induit la restauration des photopigments au niveau des cônes et des bâtonnets.
Très novateur, le Luxturna a été approuvé aux Etats-Unis fin 2017 et figure depuis 2018 aux côtés de médicaments tel le Gendicine, premier du genre mis sur le marché en 2003 en Chine pour le traitement de cancers de la tête et du cou, ou le Zalmoxis indiqué contre le rejet de greffe de moelle osseuse depuis 2016 en Europe et qui repose sur la modification génétique de cellules T allogéniques avec un vecteur rétroviral. Augurant d’une nouvelle filière thérapeutique car généralement bien tolérée, la thérapie génique pourrait supplanter certains traitements de référence et être proposée en première intention lorsque les études comparatives auront été réalisées.
Une nouvelle ère avec CRISPR, ciseaux génétiques
Pour les cas particuliers qui rendent impossible l’utilisation de la technique de thérapie génique « simple » basée sur l’ajout de gènes supplémentaires, les outils d'édition de gènes précis, tels que CRISPR-Cas9, les « Base editors » (apparus depuis 7 ans) ou les « Prime editors » (depuis 3 ans) pourraient bien changer la donne et apparaissent actuellement comme de nouvelles solutions très prometteuses.
Alors que dans l’approche initiale en thérapie génique, passant par l’apport d'une copie saine via un ADN circulaire, celle-ci reste dans le cytoplasme sans s’intégrer au génome, de même que le gène défectueux non fonctionnel n’est pas excisé et reste également en place, les nouveaux outils permettraient quant à eux d’effectuer des modifications génétiques précises et ciblées dans tous les types de cellules.

En photo : plateforme virologie
Connu dans le système bactérien depuis près de 30 ans, l’adaptation de l’outil CRISPR-Cas9 aux cellules humaines dès 2013 a valu aux professeures Jennifer Doudna et Emmanuelle Charpentier le Prix Nobel de chimie 2020 pour son utilisation potentielle chez l’homme [Voir encadré ci-dessous : Prix Nobel de chimie 2020 pour un duo féminin qui fait faire un bond à la recherche génétique]. « L’outil CRISPR-Cas9 correspond aux ciseaux qui coupent l’ADN, donc à l’enzyme Cas9 qui, complexée avec un ARN guide, permet d’engager le système » détaille la Dr Juliette Pulman, précisant que l’ARN guide consiste en une séquence d’une vingtaine d’acides aminés capable de cibler n’importe quels gènes, et bien entendu ceux impliqués dans la vision.
« Cette technique est actuellement en cours de validation dans un essai clinique de phase I/II mené par la société Editas Medicine pour traiter des patients atteint d’amaurose congénitale de Leber de type 10, lié à une mutation du gène CEP290 » indique-t-elle. Si une seule utilisation est actuellement en phase d’essai clinique, de nombreuses autres devraient suivre selon la chercheuse : « une fois la preuve de concept établie chez les animaux, ces outils représenteront le futur de la thérapie génique » avance la Dr Pulman. Nous ne serions alors qu’à l’aube d’une croissance exponentielle car de nombreuses applications sont à venir avec à la clé l’arrivée de nouveaux médicaments.
Prix Nobel de chimie 2020 pour un duo féminin qui fait faire un bond à la recherche génétique
Les professeures Emmanuelle Charpentier, microbiologiste et généticienne française, et Jennifer Doudna, américaine spécialiste de biologie structurale et de décryptage de l’ARN, ont uni leurs talents pour exploiter l'un des outils les plus pointus de la technologie génétique : les ciseaux génétiques CRISPR/Cas9.
La première, en travaillant sur la bactérie Streptococcus pyogenes, responsable de l’angine streptococcique, était fascinée par le mécanisme de défense de cette bactérie contre les attaques des phages, virus traqueurs de bactéries, tandis que la seconde s’intéressait dès 2005 aux séquences CRISPR, curieuses régions d’ADN répétitives dans le génome de bactéries. Ensemble, en croisant leurs connaissances et leurs interrogations, les deux chercheuses ont conjointement découvert un moyen simple de modifier l’ADN de n’importe quel organisme vivant du domaine végétal ou animal en opérant une véritable microchirurgie de l’ADN ! Une avancée phénoménale qui ouvre des perspectives inédites autant dans le domaine de la thérapie génique, de la thérapie cellulaire et de l’immunothérapie, que pour de nouveaux champs d’application avec les biotechnologies (en agriculture par exemple).
Parmi les applications phares en thérapie génique humaine figurent l’intervention sur les cellules pulmonaires d’enfants atteints de mucoviscidose par exemple, ou sur les muscles de patients souffrant de certaines formes de dystrophie musculaire. La technique a d’ores et déjà été utilisée pour sauver un enfant atteint d’une forme de leucémie incurable et pour améliorer la vue d’un patient souffrant de rétinite pigmentaire, qui figure au tableau des maladies génétiques de l’œil.
Un portefeuille d'outils pour un panel d'applications
Intéressant, CRISPR-Cas9 peut également être utilisé pour inactiver un gène muté produisant une protéine toxique, dans le cas des maladies autosomales dominantes. Tandis que les « Base editors » ou les « Prime editors » pourront directement corriger un gène muté.
Plusieurs équipes de l’Institut de la Vision utilisent ces différents outils innovants afin de développer de nouvelles thérapies pour les maladies rétiniennes héréditaires, notamment les équipes du Dr Dalkara, du Pr Audo et Dr Zeitz, du Dr Goureau et du Dr Del Bene. Récemment, la Dr Pulman, le Pr Sahel et la Dr Dalkara ont publié une analyse approfondie de la littérature sur les différents outils d’édition de gènes ayant été utilisés dans des modèles précliniques et dans de premières applications humaines pour traiter les maladies rétiniennes héréditaires. [Voir Figure 1].
Cette revue est publiée dans le prestigieux CRISPR Journal qui est entièrement consacré à la recherche sur les nouveaux outils d'édition de gènes et leurs applications. Elle offre une vue d’ensemble des possibilités et des limites actuelles de ce type de thérapie génique dans le traitement des maladies rétiniennes héréditaires. (1)
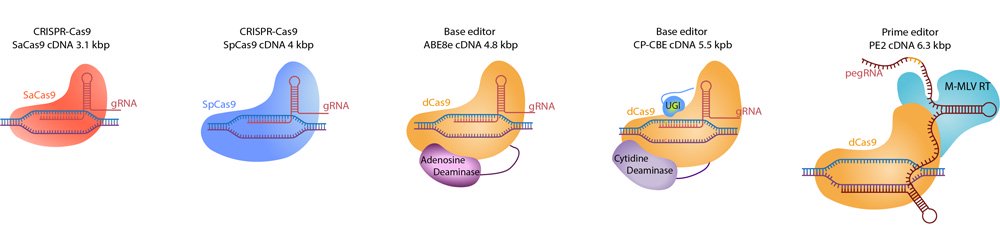
Figure 1. Principaux outils innovants d’édition de gènes utilisés pour le traitement des maladies rétiniennes héréditaires
© Juliette Pulman, et al. 2022; Published by Mary Ann Liebert, Inc.
« L’addition de gènes va continuer car c’est actuellement ce qui fonctionne le mieux » souligne la Dr Juliette Pulman, rappelant que de nombreux essais pré-cliniques continuent d’être développés dans l’addition de gènes AAV et visent la mise sur le marché de nouveaux médicaments d’ici 5 à 10 ans. « Reste que l’on a toujours 10 ans d’avance avec les différentes technologies ! » se réjouit-elle. « Concernant CRISPR-Cas9 nous sommes encore au début du développement car nous avons les ciseaux mais pas encore la colle » simplifie-t-elle, précisant que les systèmes de « Base editors », qui incluent directement la colle, n’en sont encore qu’à leurs premiers essais in vivo dans l’œil. Quant aux « Prime editors », les derniers-nés dans lacollection CRISPR, ils sont particulièrement intéressants car très puissants, intégrant à la fois les fonctions ciseaux et colle, ce qui limite aussi le risque d'effet secondaire.
Ils n'ont cependant pas encore d'application in vivo dans l'œil, la principale limite étant « mécanique » de par leur taille importante. « Les équipes ne réussissent pour l'instant pas encore à trouver de vecteur efficace pour les transporter » commente la Dr Juliette Pulman, soulignant que leur apparition est récente (3 ans) et que les développements vont prendre un peu de temps, peut-être quelques années, mais qu’ils seront probablement à terme un outil encore plus puissant que CRISPR.
Pour l’heure, CRISPR-Cas9 fait la course en tête parmi les futurs outils d’édition de gènes. En effet, les cassures du double brin d’ADN produites par la protéine Cas9 peuvent être réparées spontanément par jonction d’extrémités non-homologues (Non Homologous End Joining, NHEJ) ou en présence d’une séquence d’ADN donneur, par recombinaison homologue (Homology Directed Repair, HDR). L’ADN donneur comporte pour ce faire, de chaque côté de la coupure de l’ADN ciblé, des séquences homologues allant de 50 à 2000 nucléotides afin de pouvoir importer la séquence d’intérêt, le résultat final étant généralement de « réparer » une mutation donnée. Cependant, le système de réparation par HDR n’est pas présent dans les cellules de l’œil adulte, qui ne sont plus en division, et ne peut donc pas être exploité.
"La thérapie génique sera personnalisée sur le gène muté à l'origine de la maladie rétinienne
et adaptée à des critères phénotypiques précis"
Comparé aux nucléases à doigts de zinc (ZFN) et aux TALEN, les avantages du système CRISPR sont assez nombreux : une seule protéine (Cas9) nécessaire, qui plus est universelle donc ne faisant appel à aucune ingénierie de protéines complémentaire - contrairement aux méthodes utilisant les nucléases ZFN et les TALEN - ; un ciblage dépendant de l’appariement des bases selon les règles initiales de Watson et Crick, facilitant aussi la production des nouveaux ARN guides, et enfin la possibilité de cibler différentes séquences simultanément en utilisant un mélange de plusieurs ARN guides.
Le plein potentiel de l’extraordinaire technologie apportée par le complexe CRISPR-Cas9 capable de cibler la séquence d’ADN défaillante avec une incroyable précision commence tout juste à être perçu. Des balbutiements qui ouvrent une porte au développement de nombreux nouveaux traitements grâce notamment à la faisabilité de supprimer ou corriger des gènes défaillants à l’origine de pathologies !
Propos receuillis par Nathaly Mermet
(1) Pulman J, Sahel JA, Dalkara D. New Editing Tools for Gene Therapy in Inherited Retinal Dystrophies. CRISPR J. 2022 May 3. doi: 10.1089/crispr.2021.0141. Epub ahead of print. PMID: 35506982.
À lire aussi

Institut de la Vision : l'excellence au féminin
Nos portraits de 7 chercheuses à la pointe de l'innovation
Généticiennes, neurobiologistes, biologistes, physiciennes… : chaque jour, des chercheuses à la pointe de l’innovation font avancer la connaissance des pathologies oculaires, œuvrent au dévelo

Maladies oculaires : l'identification des défauts de gènes
Suite du reportage du Guide de la Vue consacré à quelques femmes d'excellence de l'Institut de la Vision, avec toute notre admiration pour toutes...









